미니 리뷰
암에 대한 전초기지: 보편적인 암 전용 마커
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, 상하이 200233, 중국;2 중국 하얼빈 150001 하얼빈 의과대학 제1부속병원 일반외과;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, 중국;4 닝샤 회족 자치구 인민병원, 닝샤 의과대학, 인촨 750002, 중국;5상하이 공중 보건 임상 센터 및 일반 외과부, 화산 병원 및 암 전이 연구소 및 RNA 후성 유전학 연구소, 생물 의학 연구소, 상하이 푸단 대학교, 상하이 200032, 중국
추상적인
암은 전 세계적으로 사망의 주요 원인입니다.암의 조기 발견은 모든 종류의 암의 사망률을 낮출 수 있습니다.그러나 대부분의 암 유형에는 효과적인 조기 발견 바이오마커가 부족합니다.DNA 메틸화는 일반적으로 다른 감지 가능한 유전적 변화 이전에 발생하기 때문에 DNA 메틸화는 항상 주요 관심 대상이었습니다.DNA 메틸화에 대한 새로운 가이드 위치 지정 시퀀싱을 사용하여 암의 일반적인 특징을 조사하는 동안 일련의 보편적 암 전용 마커(UCOM)가 암의 효과적이고 정확한 조기 발견을 위한 강력한 후보로 나타났습니다.현재 암 바이오마커의 임상적 가치는 낮은 민감도 및/또는 낮은 특이성으로 인해 감소하지만, UCOM의 고유한 특성은 임상적으로 의미 있는 결과를 보장합니다.폐암, 자궁경부암, 자궁내막암, 요로상피암에서 UCOM의 임상적 잠재력에 대한 검증은 다양한 암 유형과 다양한 임상 시나리오에서 UCOM의 적용을 더욱 뒷받침합니다.실제로 UCOM의 적용은 현재 암의 조기 발견, 보조 진단, 치료 효능 및 재발 모니터링에 대한 추가 평가를 통해 활발히 조사되고 있습니다.UCOM이 암을 감지하는 분자 메커니즘은 다음으로 조사해야 할 중요한 주제입니다.실제 시나리오에서 UCOM을 적용하려면 구현과 개선도 필요합니다.
키워드
암 탐지;암 검진;DNA 메틸화;암 후생유전학;암 바이오마커
새로운 것이 시급히 필요한 이유 바이오마커?
100년 넘게 암과 싸워온 후에도 암은 여전히 인류에게 가장 치명적인 생물학적 위협입니다.암은 20201년에 1,930만 건의 신규 사례와 거의 1,000만 명의 사망을 기록할 정도로 전 세계적으로 건강 문제로 남아 있습니다. GLOBOCAN에 따르면 2020년에 중국에서 약 460만 건의 새로운 암 사례가 진단되었으며 이는 전 세계 신규 암 사례의 23.7%를 차지합니다1.또한, 2020년 중국에서는 약 300만 명이 암으로 사망했는데, 이는 전 세계 암 관련 사망의 30%에 해당합니다1.이 통계에 따르면 중국은 암 발생률과 사망률에서 1위를 차지하고 있다.더욱이 암 5년 생존율은 40.5%로 미국의 5년 생존율보다 1.5배 낮다2,3.인간 개발 지수가 높은 국가에 비해 중국의 상대적으로 낮은 생존율과 높은 사망률은 효율적이고 비용 효과적인 암 예방 및 감시 시스템이 시급히 필요함을 시사합니다.암의 조기 발견은 의료 시스템에서 가장 중요한 요소 중 하나입니다.암의 조기 발견은 거의 모든 암 유형의 초기 단계에서 예후와 생존율을 향상시킬 수 있습니다4.성공적인 검진 전략으로 인해 자궁경부암, 유방암, 대장암, 전립선암의 발병률과 사망률이 크게 감소했습니다.
그러나 암을 조기에 발견하는 것은 쉬운 일이 아닙니다.조기 암의 생물학 및 예후를 조사하고, 신뢰할 수 있는 조기 발견 바이오마커를 식별 및 검증하며, 접근 가능하고 정확한 조기 발견 기술을 개발하는 것은 항상 이 과정에서 가장 큰 장애물이었습니다4.암의 정확한 검출은 양성 병변과 악성 병변을 구별할 수 있어 불필요한 절차를 피하고 추가 질병 관리를 촉진하는 데 도움이 됩니다.현재의 조기 발견 전략에는 내시경 기반 생검, 의료 영상, 세포학, 면역분석 및 바이오마커 테스트가 포함됩니다5-7.내시경 기반 생검은 침입적이고 비용이 많이 들기 때문에 전문 인력에 의존하는 주요 의료 절차로서 본질적으로 큰 부담을 안고 있습니다.세포검사와 마찬가지로 두 가지 선별 방법 모두 의료 전문가에 따라 다르며 개인 판단에 기반을 두고 있으며 성능은 이상적이지 않습니다8.대조적으로, 면역분석법은 위양성 비율이 높기 때문에 매우 부정확합니다.검진 전술인 의료 영상에는 고가의 장비와 전문 기술자가 필요합니다.따라서 의료영상은 접근성이 낮아 극히 제한적이다.이러한 모든 이유로 인해 바이오마커는 암의 조기 발견을 위한 더 나은 선택인 것으로 보입니다.
대응: Yinshan Li 및 Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 및
https://orcid.org/0000-0001-9920-1133
2023년 8월 22일에 접수됨;2023년 10월 12일 승인;
2023년 11월 28일 온라인에 게시되었습니다.
www.cancerbiomed.org에서 이용 가능
©2023 암 생물학 및 의학.크리에이티브 커먼즈
저작자표시-비영리 4.0 국제 라이센스
바이오마커는 현재 단백질, DNA 돌연변이 마커, 후생유전학적 마커, 염색체 이상, 종양에서 직접 유래된 RNA 마커 또는 체액에서 간접적으로 얻은 종양 단편으로 분류됩니다.단백질 마커는 암 선별 및 진단에 가장 널리 적용되는 바이오마커입니다.단백질 바이오마커는 스크리닝 바이오마커로서 양성 병변에 의해 영향을 받는 경향이 있어 제한적이며, 이로 인해 α-태아단백질 및 전립선 특이 항원(PSA)9,10에 대해 보고된 바와 같이 과잉 진단 및 과잉 치료가 발생합니다.RNA 마커에는 유전적 발현 패턴과 기타 비암호화 RNA 마커가 포함됩니다. 유전적 발현 RNA 마커의 조합은 소변 샘플을 사용하여 검출할 수 있는데, 그 민감도는 원발성 종양에 대해 만족스럽지 못하며(60%) 검출이 가능합니다. 정상적인 환경에서 RNA는 쉽게 분해되는 특성의 영향을 받습니다11.유전적 및 후생적 마커는 모두 종양의 유병률과 암 유형의 제한 문제에 직면해 있습니다.
DNA 메틸화는 1983년 Feinberg가 처음으로 암과 연관시킨 이후 조기 발견 바이오마커로서 강력한 후보였습니다. DNA 메틸화 이상은 암 전 단계부터 암의 모든 단계에서 관찰됩니다.비정상적인 DNA 과메틸화는 일반적으로 종양 억제 인자에 대응하기 위해 유전자 프로모터의 CpG 섬에서 발생합니다.연구에서는 또한 비정상적인 DNA 과메틸화가 발달 조절 인자의 상향 조절에 관여한다고 제안했습니다.일반적으로 발달 조절 인자 및 과메틸화 암과 관련된 DNA 메틸화 밸리는 유전자 발현 모드를 보다 안정적인 DNA 메틸화 의존 모드로 전환하고 메틸화 히스톤 H3K27me3 및 관련 폴리콤 단백질과의 연결을 감소시킬 수 있습니다.
공개된 다수의 DNA 메틸화 마커 중 일부는 시장에 성공적으로 데뷔했습니다.그러나 현재 상용화된 DNA 메틸화 마커와 진단 패널은 여러 가지 이유로 암의 조기 발견 가능성을 아직 완전히 활용하지 못하고 있습니다18.대부분 데이터베이스 정보를 사용하여 허용 가능한 성능을 보여주지만, 이러한 바이오마커는 실제 샘플이 종종 더 복잡하고 데이터베이스에서 선택된 샘플만큼 대표성이 없다는 사실로 인해 현실 세계에서는 덜 이상적으로 수행됩니다.차세대 염기서열 분석 기반 다발성 암 메틸화 조기 발견은 1기 암과 2기 암에서 각각 16.8%와 40.4%의 민감도를 보이는 것으로 나타났습니다19.조기 발견 테스트에는 더 큰 안정성과 더 정확한 바이오마커가 필요합니다.
가이드 포지셔닝 시퀀싱(GPS)을 이용한 보편적인 암 전용 마커(UCOM) 발견
수십 년간의 암 연구에도 불구하고 만족스러운 예방과 치료가 실현되지 않았습니다.연구자들이 암을 철저하게 평가할 수 있도록 하려면 새로운 방법론이 필요합니다.지난 23년 동안 세포사멸 회피, 조직 침입 및 전이 등과 같은 6가지 암 특징이 비돌연변이성 후성적 재프로그래밍 및 다형성 미생물군집과 같은 특징을 포함하여 14가지로 확장되었습니다20,21.암과 관련된 더 많은 세부 사항이 공개됨에 따라 암 연구에 더 많은 관점이 도입됩니다.암 연구는 점차 두 가지 방향(공통성과 개별성)으로 새로운 시대를 맞이하고 있습니다.최근 몇 년 동안 정밀 종양학이 발전함에 따라 암 연구의 초점은 개별화된 표적 치료법과 암의 이질성 쪽으로 기울어지고 있습니다22.따라서 최근 확인된 암 바이오마커는 PAX6 강제경부암23 및 대장암에 대한 BMP324과 같은 특정 암 유형에 주로 초점을 맞추고 있습니다.이러한 암 유형별 바이오마커의 성능은 다양하지만 생물학적 시료 확보의 한계와 높은 비용으로 인해 감수성이 있는 개인이 모든 암에 대한 검진을 동시에 받는 것은 여전히 불가능합니다.초기 단계의 모든 유형의 암에 효과적인 단일하고 강력한 바이오마커를 식별할 수 있다면 이상적일 것입니다.
이러한 이상적인 목표를 달성하려면 잠재적인 바이오마커 유형 목록에서 더 나은 바이오마커 후보를 선택해야 합니다.모든 유전적 및 후생적 프로필 중에서 DNA 메틸화 이상은 암과 관련이 있는 것으로 알려져 있으며, 연대순으로 가장 먼저 발생하는 암 관련 이상 중 일부입니다.DNA 메틸화에 대한 조사는 일찍부터 시작됐지만 연구 방법이 부족해 방해를 받아왔다.종양 형성을 더 잘 이해하려면 게놈에 있는 2,800만 개의 잠재적인 메틸화 CpG 부위 중에서 관리 가능한 숫자를 감지하고 게놈에 정렬해야 합니다.DNA 메틸화 시퀀싱의 최적 표준으로 간주되는 WGBS(Whole Genome Bisulfite Sequencing)는 DNA 단편을 파괴하고 게놈 복잡성을 낮추는 Bisulfite 처리 특성으로 인해 암세포에서 Cs의 50%만 덮을 수 있습니다. Cs에서 Ts25로의 변환.450k 칩과 같은 다른 방법은 게놈 메틸화의 1.6%만을 커버합니다.450k 데이터를 기반으로 DNA 메틸화 검출 패널은 6가지 유형의 1기 암에 대해 35.4%의 민감도를 갖습니다26.분석 과정에서 검출 방법에 따라 발생하는 암 유형의 한계, 성능 저하, 노이즈 등은 범암 검출 패널의 가장 큰 장애물이 되었습니다.
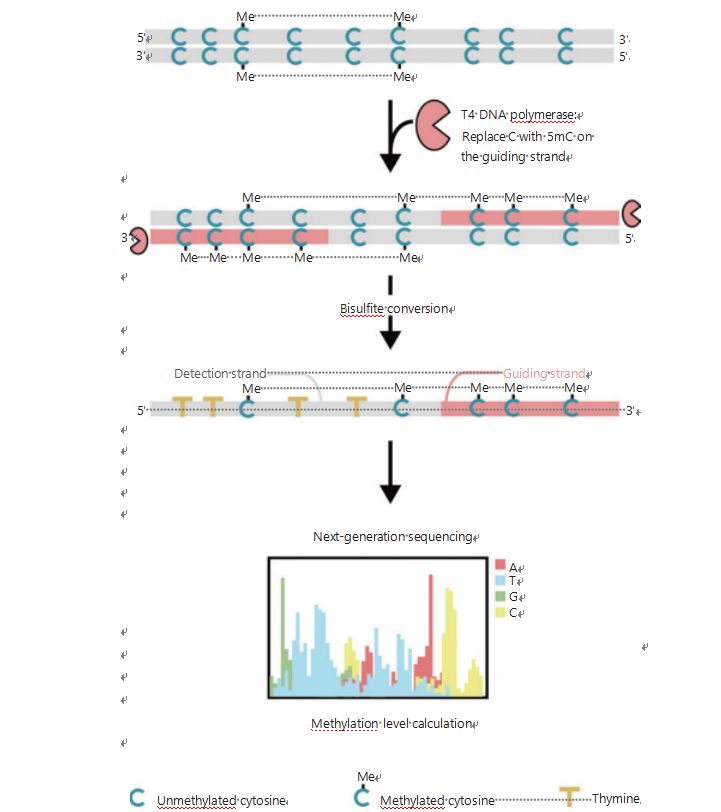
종양 형성 및 전이 동안 세포의 후생적 패턴을 더 잘 조사하기 위해 우리는 4억 건의 읽기에서 CpG 사이트의 최대 96%를 포괄하는 게놈 차원의 DNA 메틸화 검출을 위한 고유한 GPS를 개발했습니다.GPS는 쌍말단 서열분석을 통해 5'말단의 DNA 메틸화 계산 정렬을 안내하는 bisulfite 처리 후 전환 불가능한 메틸 시토신의 DNA 단편의 3'말단을 사용하는 양측 서열분석 방법입니다(그림 1)25.주형 가닥으로 작용하는 메틸-시토신 유도 가닥은 기존 WGBS에서 가장 많이 버려진 시퀀싱 데이터를 복구하는 높은 GC 영역 정렬을 돕습니다.GPS의 높은 적용 범위 기능은 엄청난 양의 DNA 메틸화 정보를 제공하므로 이전에 조사되지 않은 지역에서 훨씬 더 높은 해상도로 암 메틸화 프로필을 조사할 수 있습니다.
GPS는 암 연구를 크게 단순화하고 잠재적으로 종양 형성 및 전이에 대한 보편적인 설명을 찾을 수 있는 암의 동질성을 조사할 수 있는 강력한 도구를 제공합니다.암세포주의 GPS 데이터를 분석하던 중 특이한 현상이 자주 발견됐다.여러 유형의 암 샘플에서 비정상적으로 과메틸화되어 있는 것으로 보이는 여러 영역이 있었습니다.이 예상치 못한 발견은 나중에 UCOM 역할을 하는 것으로 검증되었습니다.The Cancer Genome Atlas(TCGA) 데이터베이스에 있는 17개 유형의 암에서 추출한 7,000개 이상의 샘플이 분석되었으며, 그 중 모든 유형의 암에서 과메틸화되는 히스톤 관련 유전자인 최초의 UCOM인 HIST1H4F가 확인되었습니다27.그런 다음 TCGA 데이터베이스, GEO(Gene Expression Omnibus) 데이터베이스 및 실제 임상 샘플에서 일련의 UCOM을 찾아 검증했습니다.현재 HIST1H4F, PCDHGB7, SIX6이 발견되어 UCOM으로 검증되었습니다.UCOM의 예상치 못한 발견은 암의 조기 발견 필요성에 대한 강력한 해답을 제공합니다.UCOM은 여러 암의 단일 마커 검출을 위한 솔루션을 제공합니다.
UCOM의 특성
검증 시 UCOM은 UCOM이 현재 바이오마커의 효능을 능가할 수 있도록 하는 4가지 주요 특성을 나타내는 것으로 나타났습니다(그림 2).
악성종양 특유의
UCOM은 암성 또는 전암성 병변에 고유하며 정상적인 생리학적 변화에 영향을 받지 않습니다.현재 조기 발견 및/또는 선별검사에 널리 적용되고 있는 일부 암 관련 표지자는 과잉진단을 초래하고 있습니다.임상적으로 인증된 선별 도구인 PSA 수치의 상승은 전립선 비대증 및 전립선염과 같은 양성 질환에서도 검출됩니다10.과잉진단과 그에 따른 과잉치료는 장, 비뇨기계, 성기능 합병증으로 인해 삶의 질을 저하시키는 원인이 됩니다28.CA-125와 같이 임상 환경에서 널리 사용되는 기타 단백질 기반 바이오마커는 과잉 진단 및 과잉 치료를 초래하면서도 큰 이점을 얻지 못했습니다29.악성 종양에 대한 UCOM의 높은 특이성은 이러한 단점을 방지합니다.UCOM, PCDHGB7은 고등급 편평 상피내 병변(HSIL)과 자궁경부암을 정상 샘플 및 저등급 편평 상피내 병변(LSIL)과 효율적으로 구별하는 반면, 대부분의 다른 바이오마커는 자궁경부암을 정상 샘플과만 구별할 수 있습니다30.PCDHGB7은 정상 자궁내막과 자궁내막 증식 사이에 유의미한 차이를 감지하지 못하지만, 정상 자궁내막과 비정형 증식 사이에는 유의미한 차이가 감지되며, PCDHGB731을 기반으로 하면 정상 자궁내막과 자궁내막암(EC) 사이에는 훨씬 더 큰 차이가 감지됩니다.UCOM은 데이터베이스 및 임상 샘플의 악성 병변에 고유합니다.환자의 관점에서 볼 때 고유한 UCOM은 성능이 좋지 않은 다양한 불안정 바이오마커의 복잡한 징후를 이해하고 평가 과정에서 이에 상응하는 불안을 줄여줍니다.임상의의 관점에서 볼 때 독특한 UCOM은 악성 종양과 양성 병변을 구별하여 환자 분류에 도움이 되고 불필요한 의료 절차와 과잉 치료를 줄입니다.따라서 고유한 UCOM은 의료 시스템 중복을 줄이고 시스템 문제를 완화하며 도움이 필요한 사람들에게 더 많은 의료 자원을 제공합니다.
그림 1 DNA 메틸화 검출을 위한 GPS 작업 흐름의 도식25.회색 선: 입력 DNA 서열;빨간색 선: T4 DNA 중합효소로 처리된 DNA, 입력의 3' 말단에서 시토신을 5'-메틸시토신으로 대체;파란색 C와 Me: 메틸화된 시토신;파란색 C: 메틸화되지 않은 시토신;노란색 T: 티민25.
전부 아니면 전무
UCOM은 암세포에만 존재하며 거의 모든 암세포에서 안정적으로 검출됩니다.HIST1H4F는 거의 모든 종양 유형에서 과메틸화되는 것으로 검증되었지만 정상 샘플에서는 그렇지 않았습니다.유사하게, PCDHGB7 및 SIX6도 모든 종양 샘플에서 과메틸화되어 있지만 정상 샘플에서는 그렇지 않은 것으로 나타났습니다30-32.이 고유한 특성은 감지 한계 및 감도와 관련하여 UCOM의 성능을 크게 향상시킵니다.표본에서 암세포의 2% 정도만 분화될 수 있으므로 UCOM은 대부분의 기존 바이오마커보다 훨씬 더 민감한 바이오마커가 됩니다30. 대장암 검출에 사용되는 바이오마커로서 KRAS 돌연변이는 대장암 사례의 약 36%에만 존재합니다. 진단 가능성이 낮다는 것을 암시합니다33.대장암에서 KRAS 돌연변이의 낮은 유병률은 KRAS를 다른 바이오마커와 결합하는 것을 제한합니다.실제로, 바이오마커의 조합은 처음에는 유망해 보일 수 있지만 검출 분석에서 훨씬 더 큰 노이즈를 보여주면서 항상 만족스러운 결과를 생성하는 것은 아니며 일반적으로 더 복잡한 실험 절차를 포함합니다.대조적으로, PCDHGB7 및 기타 UCOM은 모든 암에 존재합니다.UCOM은 복잡한 소음 제거 분석 프로세스를 제거하는 동시에 다양한 유형의 암 샘플에서 암 성분을 최고의 정밀도로 탐지합니다.풍부한 표본에서 암을 발견하는 것은 어렵지 않지만, 작은 표본에서 암을 발견하는 것은 극히 어렵습니다.UCOM은 소량의 암을 탐지할 수 있습니다.
그림 2 UCOM의 특성.
병리학적 변화 이전의 암 검출
UCOM은 병리학적 변화 이전의 전암 단계에서 검출될 수 있습니다.후생적 바이오마커로서 UCOM 이상은 표현형 이상보다 초기 단계에서 발생하며 종양 형성, 진행 및 전이 전반에 걸쳐 검출 가능합니다34,35.시간이 지남에 따라 UCOM의 민감도는 초기 암 및 전암 병변을 탐지하는 데 있어 UCOM 성능을 향상시킵니다.생검 및 세포학을 기반으로 한 조기 암 발견은 경험이 가장 많은 병리학자에게도 어려울 수 있습니다.질확대경검사를 통해 얻은 단일 생검은 HSIL+ 샘플의 60.6%에서 양성으로 보고되었습니다.민감도를 높이려면 여러 병변에 대해 추가 생검이 필요합니다36.대조적으로, UCOM, PCDHGB7은 HSIL+ 샘플에 대해 82%의 감도를 가지며, 이는 생검 및 대부분의 바이오마커의 감도를 능가합니다30.메틸화 마커인 FAM19A4는 CIN2+에 대해 69%의 민감도를 가지며, 이는 세포학과 유사하지만 CIN1을 정상 샘플과 구별할 수 없습니다.UCOM은 훨씬 더 민감한 조기 발견 바이오마커인 것으로 나타났습니다.경험 기반 병리학자에 비해 UCOM은 초기 암에 대한 탁월한 검출 감도를 가지며, 이는 결국 암 예후 및 생존율 향상에 기여합니다30.또한 UCOM은 경험이 풍부한 병리학자가 부족한 지역에 접근할 수 있는 탐지 플랫폼을 제공하고 탐지 효율성을 크게 향상시킵니다.균일한 샘플링 및 탐지 절차를 통해 UCOM 탐지는 더 적은 전문 인력과 의료 자원이 필요한 검사 프로토콜에 더 적합한 안정적이고 해석하기 쉬운 결과를 제공합니다.
감지가 용이함
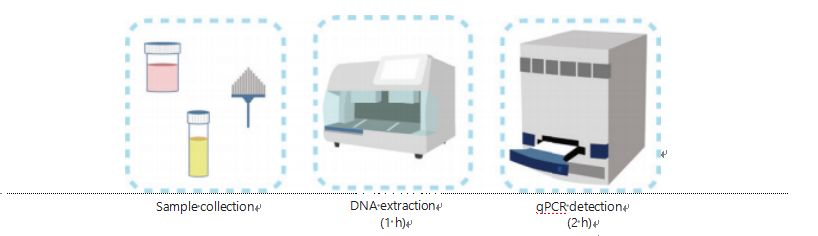
DNA 메틸화 검출을 위한 현재 방법은 복잡하고 시간이 많이 걸립니다.대부분의 방법에는 중아황산염 변환이 필요하며, 이로 인해 샘플 품질이 저하되고 불안정하고 부정확한 결과가 나올 수 있습니다.바이설파이트 치료로 인한 낮은 재현성은 잠재적으로 의사와 환자에게 혼란을 야기하고 후속 조치 및/또는 치료 전략을 더욱 방해합니다.따라서 우리는 샘플의 문제가 있는 중아황산염 처리를 방지하고 임상 적용 요구 사항을 수용하며 접근성을 향상시키기 위해 UCOM 검출 방법을 추가로 수정했습니다.우리는 실시간 형광 정량 PCR(Me-qPCR)과 결합된 메틸화 민감 제한 효소를 사용하여 손쉬운 처리 절차를 사용하여 3시간 이내에 UCOM의 메틸화 상태를 정량화하는 새로운 방법을 개발했습니다(그림 3).Me-qPCR은 체액의 임상 수집 및 자가 수집 소변 샘플과 같은 다양한 샘플 유형을 수용할 수 있습니다.수집된 임상 샘플은 표준화되고 자동화된 DNA 추출을 사용하여 처리 및 저장하고 쉽게 검출을 진행할 수 있습니다.그런 다음 추출된 DNA를 Me-qPCR 플랫폼에 직접 적용하여 원팟 반응 및 정량 결과를 출력할 수 있습니다.특정 암 유형에 적합하고 검증된 진단 모델을 사용하여 간단한 결과 분석을 수행한 후 UCOM 검출 결과의 최종 결정을 반정량적 값으로 해석하여 제시합니다.Me-qPCR 플랫폼은 EZ DNA Methylation-Gold 키트 프로토콜에 따라 3시간의 bisulfite 변환을 절약하면서 UCOM 검출에서 기존의 bisulfite-pyrosequencing보다 성능이 뛰어납니다.혁신적인 메틸화 검출 플랫폼은 UCOM 검출을 더욱 안정적이고 정확하며 접근성 있게 만듭니다30.
그림 3 UCOM 탐지 프로세스.검체 유형에는 전문적으로 검체를 채취한 BALF, Pap Brush 및/또는 자가 수집 소변이 포함됩니다.DNA 추출 공정은 자동 추출기에 수용될 수 있으며, 그 제품은 qPCR에 의해 직접 검출될 수 있습니다.
UCOM의 적용
폐암
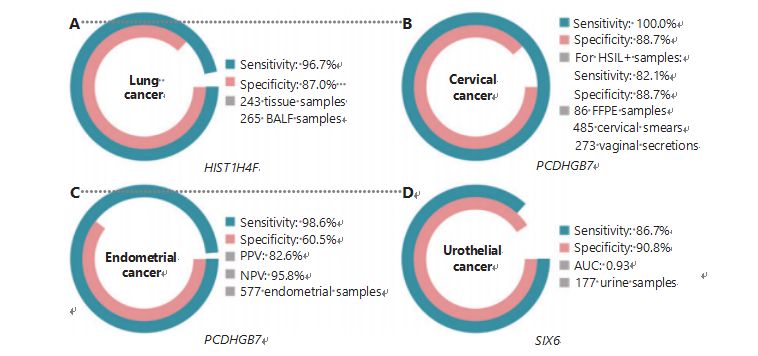
폐암은 전 세계적으로 두 번째로 많이 진단되고 가장 치명적인 암으로, 신규 발병 건수의 11.4%, 신규 사망 건수의 18.0%를 차지합니다1.모든 진단 중 85%는 비소세포폐암(NSCLC)이고 15%는 악성 수준이 더 높은 소세포폐암(SCLC)입니다38.저선량 컴퓨터 단층촬영(LDCT) 스캐닝은 현재 권장되는 폐암 선별 방법이며 조기 발견을 개선하고 사망률을 줄이는 것으로 나타났습니다6.그러나 낮은 특이성과 낮은 접근성으로 인해 LDCT는 CEA39와 같은 다른 일반적인 암 표지자와 마찬가지로 아직 만족스러운 선별 방법으로 사용되지 않았습니다.LDCT 검진 전략의 진단 누락 및 오진에 대한 비용과 가능성은 폐암 검진 홍보의 진행을 방해합니다40.UCOM인 HIST1H4F는 기관지폐포액(BALF) 샘플의 조기 발견 바이오마커로서 엄청난 잠재력을 가지고 있습니다.HIST1H4F는 폐 선암종과 폐 편평 세포 암종에서 과메틸화되어 있으며 검출 특이도는 96.7%, 민감도는 87.0%(그림 4A)이며 1기 암에 대한 탁월한 성능을 보입니다27.HIST1H4F는 NSCLC의 경우 특이도 96.5%, 민감도 85.4%, SCLC27의 경우 각각 96.5%와 95.7%의 민감도를 갖습니다.또한 췌장암과 대장암을 포함한 다른 8가지 유형의 암 샘플을 통해 HIST1H4F가 8가지 유형 모두에서 과메틸화되어 있음이 확인되었습니다.
자궁 경부암
자궁경부암은 2020년 여성에서 네 번째로 가장 자주 진단되는 암이자 암 사망 원인 중 네 번째로, 전 세계 신규 사례의 3.1%, 암 관련 사망의 3.4%를 차지했습니다1.2030년까지 세계보건기구(WHO)가 제시한 자궁경부암 근절을 위해서는 자궁경부암의 조기 발견이 필수다.침습성 자궁경부암은 초기에 발견하면 5년 생존율이 92%에 이른다41.미국 암학회(ACS) 지침에서는 자궁경부 세포검사, 일차 HPV 검사 또는 선별검사 공동검사를 제안하고 있습니다42.자궁경부 세포검사는 침습적이며 CIN2+ 사례의 63.5%만 감지할 수 있습니다37.
이와 대조적으로 PCDHGB7은 자궁 경부 세포진 검사와 질 분비물을 사용하여 훨씬 더 나은 성능을 보였으며 초기 단계에서 HSIL과 LSIL을 효율적으로 구별할 수 있습니다.PCDHGB7 단독은 자궁경부암에 대해 100.0%의 민감도와 88.7%의 특이성을 가지며(그림 4B), HSIL+ 샘플의 경우 82.1%의 민감도와 88.7%의 특이성을 나타냅니다30.PCDHGB7은 또한 자궁경부암에 대한 질 분비물 샘플에서 90.9%의 민감도와 90.4%의 특이성을 갖고 있어 수집이 훨씬 쉽습니다30.고위험(hr)HPV 테스트 또는 Thinprep 세포학 테스트(TCT)와 결합하면 PCDHGB7은 민감도가 95.7%, 특이도가 96.2% 증가하여 hrHPV 테스트(20.3%), TCT(51.2%)를 크게 능가합니다. ), 두 가지를 합치면(57.8%) 자궁경부암에 해당됩니다30.PCDHGB7은 또한 TCGA 데이터베이스에서 17가지 유형의 암에서 과메틸화되는 것으로 나타났으며 이는 UCOM 제품군에 적합함을 나타냅니다.
그림 4 UCOM은 대규모 임상 연구를 통해 네 가지 유형의 암에서 검증되었습니다.A. 508개 샘플의 폐암 검출에서 UCOM인 HIST1H4F의 성능.B. 844개 샘플의 자궁경부암 검출에서 UCOM인 PCDHGB7의 성능.C. 577개의 자궁내막 Pap 및 Tao 브러시 샘플의 자궁내막암 검출에서 UCOM인 PCDHGB7의 성능.D. 177개 샘플의 요로상피암 검출에서 UCOM인 SIX6의 성능.
EC
EC는 전 세계적으로 가장 흔한 여성 생식기 암 중 하나로, 매년 약 420만 건의 새로운 사례가 발생하고 암 관련 사망의 1%가 발생합니다1.초기 단계에서 성공적인 진단을 통해 EC는 치료가 가능하며 1기 암의 5년 생존율이 95%입니다.비정상 자궁출혈 등 증상이 있는 환자는 EC43이 발생하는 비율이 5~10%에 불과함에도 불구하고 주기적인 임상 평가를 받고 침습적이고 고통스러운 생검 절차를 거칩니다.일반적인 검출 방법인 질경유 초음파는 양성 자궁내막 변화와 악성 자궁내막 변화를 구별할 수 없고 높은 위양성률로 인해 신뢰성이 매우 낮습니다44.
널리 사용되는 EC 바이오마커인 혈청 CA-125와 PCDHGB7의 병행 비교가 수행되었습니다.혈청 CA-125의 민감도는 24.8%였으며, 이는 CA-125가 92.3%의 특이도에도 불구하고 EC에 대한 부적절한 지표임을 시사합니다31.Pap 브러시 샘플을 사용한 PCDHGB7 검출은 ECatall 단계에 대해 80.65%의 민감도와 82.81%의 특이성을 보인 반면, Tao 브러시는 61.29%의 민감도와 95.31%의 특이성을 나타냈습니다31.Me-qPCR을 기반으로 하는 PCDHGB7 진단 모델은 Pap 및 Tao 브러시 샘플을 사용하여 98.61%의 민감도, 60.5%의 특이성, 85.5%의 전체 정확도를 산출했습니다(그림4C)31.
요로상피암
방광암, 신우암, 요관암으로 구성된 요로상피암은 2020년 전 세계적으로 7번째로 가장 빈번하게 진단된 암으로, 신규 발병 건수의 5.2%, 사망 건수의 3.9%를 차지했습니다1.그 중 50% 이상이 방광암인 요로상피암은 2022년 미국에서 네 번째로 가장 빈번하게 진단된 암으로, 새로 진단된 사례의 11.6%를 차지했습니다3.방광암의 약 75%는 점막이나 점막하층에 국한된 비근육 침윤성 방광암으로 분류됩니다45.방광경 생검은 FISH(형광 현장 혼성화) 및 세포학 검사를 통해 시행되는 요로상피암 진단을 위한 최적의 표준입니다.FISH와 세포학은 진단 성능이 좋지 않으며 방광경 검사는 침습적이며 미세 병변을 놓치고 병변을 잘못 해석하며 잠재적으로 암의 확산이나 재발을 일으킬 수 있는 근본적인 위험이 있습니다46.이전에 검증된 UCOM인 PCDHGB7도 요로상피암에서 과메틸화되어 있는 것으로 나타났으며, 곡선 아래 면적은 0.86으로 잠재적인 진단 능력을 시사합니다.더 많은 UCOM을 추가로 검증하고 더 많은 샘플 유형을 더 잘 수용하기 위해 새로운 UCOM인 SIX6을 검사한 결과 Me-qPCR 플랫폼에서 소변 샘플을 사용하여 요로상피암을 조기에 발견하는 데 탁월한 진단 가능성이 나타났습니다.소변 샘플을 사용한 SIX6 검출은 86.7%의 경쟁력 있는 민감도와 90.8%의 특이도를 보여주었으며(그림 4D), 비침습적이고 획득하기 쉽습니다32.전이 모니터링 및 치료 효능 평가에서 SIX6의 잠재력은 현재 조사 중입니다.
미래와 도전
UCOM은 여러 암의 진단 가능성에 있어서 강력한 성능을 가지고 있지만 아직 해야 할 일이 많이 남아 있습니다.우리는 UCOM 목록을 확대해 왔으며 전통적으로 발견하기 어려운 암을 포함하여 더 많은 유형의 암에서 UCOM을 적극적으로 검증해 왔습니다.TCGA 데이터베이스의 검증 결과는 더 많은 유형의 암과 더 많은 상황에서 UCOM의 적용을 더욱 확증했습니다.예비 조사에서 UCOM은 담관암종과 췌장 선암종에 대한 강력한 진단 가능성을 가지고 있는 것으로 나타났습니다. 이는 현재 선별 방법으로는 초기 단계에서 진단하기가 거의 불가능합니다32,47.UCOM으로 희귀 암을 검출하는 능력은 향상된 액체 생검 플랫폼48을 통해 순환 종양 DNA(ctDNA)와 함께 활용될 수 있습니다.혈장 DNA 기반 범암 검출 패널을 사용한 연구에서는 57.9%의 민감도가 나타났습니다49.높은 특이성에도 불구하고 전반적인 성능을 보면 여전히 개선의 여지가 있음을 알 수 있습니다.
UCOM의 고유한 특성은 치료 효능 평가 및 재발 모니터링에서 UCOM 잠재력 조사를 지원해 왔습니다.RECIST(고형 종양 반응 평가 기준)에 따르면 의료 영상은 재발 모니터링 및 치료 효능 평가에 권장되는 방법인 반면, 종양 표지자는 평가에 단독으로 사용됩니다50.그러나 실제로 영상 접근법은 빈도와 타이밍에 큰 영향을 미치므로 환자를 더 높은 위험과 비용에 노출시킵니다51,52.SIX6은 유방암 전이에 대한 예측변수 역할을 하는 것으로 검증되었습니다32.액체 생검 기반 ctDNA 모니터링을 통해 방사선학적 검출보다 몇 달 앞서 최소한의 잔여 질환에 대한 실시간 감시가 가능해 이상적으로는 재발 관련 암 진행을 지연 및 예방할 수 있습니다53.예비 결과는 UCOM이 수술 및 치료 직후 실시간으로 암성 과메틸화 수준을 반영한다는 것을 시사합니다32.UCOM이 나타내는 높은 민감도와 다양한 비침습적 샘플 유형에서의 적용 가능성으로 인해 UCOM은 높은 환자 순응도를 유지하면서 정밀한 재발 모니터링 바이오마커 역할을 할 수 있습니다.
동시에 시험에 대한 대중의 접근성은 추가적인 노력이 필요한 또 다른 주요 문제입니다.더 많은 환자에게 혜택을 제공하기 위해 더 많은 병원에서 UCOM 탐지 협력이 채택되었지만 중국 시골에서는 무료 탐지 및 검사가 적극적으로 수행되었습니다.UCOM은 특히 저개발 지역의 경우 실행 가능한 검사 도구로 자격을 얻으려면 향상된 접근성이 필요합니다.
UCOM 응용 프로그램의 조기 발견 결과는 유망하지만 UCOM에 대해서는 알려지지 않은 부분이 많이 존재합니다.적극적인 탐색을 통해 UCOM이 암에 보편적으로 존재하는 이유에 대한 추가 연구가 필요합니다.UCOM의 기초가 되는 후생유전학적 조절 메커니즘은 추가 조사의 가치가 있으며, 이는 암 치료법의 새로운 방향을 정당화할 수 있습니다.종양 동질성과 이질성 사이의 상호 작용으로 돌아가서, 우리는 왜 UCOM이 특정 암 유형과 밀접하게 연관되어 있는 대부분의 암 바이오마커에서 예외가 될 수 있는지에 관심이 있습니다.종양 형성, 종양 진행 및 전이에서 UCOM으로 확인된 DNA 메틸화 이상의 역할은 세포 정체성을 상실하고 회복하는 과정에서 결정되지 않았으며 철저한 검사가 필요합니다.또 다른 주요 관심은 역방향으로 암 흔적의 정확한 검출 및 종양 조직 기원의 식별에 접근하기 위해 조직 고유 마커와 UCOM의 균질성 특성을 통합하는 범위에 있습니다.UCOM은 암을 예방하고, 암을 발견하고, 잠재적으로 암을 방어하고 제거하는 데 이상적인 도구가 될 수 있습니다.
지원금 부여
이 작업은 중국 국가 핵심 R&D 프로그램(보조금 번호 2022BEG01003), 중국 국립자연과학재단(보조금 번호 32270645 및 32000505), 흑룡강성 보건위원회의 보조금(보조금 번호 2020-111)의 지원을 받았습니다. , 허쩌 과학 기술 연구소의 보조금 (보조금 번호 2021KJPT07).
이해 상충 진술서
Wei Li는 Shanghai Epiprobe Biotechnology Co., Ltd.의 R&D 이사입니다. Wenqiang Yu는 Epiprobe의 과학 자문위원회에서 활동하고 있습니다.W. Yu와 Epiprobe는 이 작업과 관련된 출원 중인 특허를 승인했습니다.다른 모든 저자는 경쟁 이익을 선언하지 않습니다.
저자 기여
프로젝트 구상 및 설계: Chengchen Qian 및 Wenqiang Yu.
논문을 썼습니다: Chengchen Qian.
일러스트 제작: Chengchen Qian.
원고 검토 및 편집: Xiaolong Zou, Wei Li, Yinshan Li 및 Wenqiang Yu.
참고자료
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A 등.2020년 글로벌 암 통계: GLOBOCAN 추정치
185개국 36개 암에 대한 전 세계 발병률과 사망률.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S 등.2022년 중국과 미국의 암 통계: 프로필, 추세 및 결정 요인.Chin MedJ(영어).2022년;135: 584-90.
3. 시겔 RL, 밀러 KD, WagleNS, JemalA.암 통계, 2023. CA Cancer J Clin.2023년;73:17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M 등.암의 조기 발견.과학.2022년;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.전략
대장암 검진.위장병학.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.폐암검진.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P 등.자궁경부암 검진에 대한 IARC의 관점.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.LMIC의 자궁경부암 검진을 위한 질확대경 검사의 과제와 인공 지능을 통한 솔루션.BMC 메디드.2020;18:169.
9. 존슨 P, Zhou Q, Dao DY, Lo YMD.간세포암종의 진단 및 관리에 있어서 순환하는 바이오마커.Nat Rev Gastroenterol Hepatol.2022년;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Serum PSA 기반 유럽 및 전 세계 전립선암 조기 발견: 과거, 현재, 미래.Nat Rev Urol.2022년;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, 와타나베 J, KajitaY,
외.방광의 이행세포암종 검출 및 계층화를 위한 다중 RNA 소변 검사 개발.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. 저메틸화는 일부 인간 암의 유전자를 정상적인 암과 구별합니다.자연.1983년;301: 89-92.
13. Ng JM, Yu J. 대장암의 잠재적 바이오마커로서 종양 억제 유전자의 과메틸화 촉진자.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. 암 후생유전체학: DNA 메틸롬 및 히스톤 변형 지도.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. 암의 DNA 메틸화 환경 탐색.트렌드 제넷.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P 등.인간 배아줄기세포의 다계통 분화에 대한 후생유전학적 분석.셀.2013년;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X 등.게놈 전체 분석을 통해 DNA 메틸화 계곡의 저메틸화 촉진에 Polycomb의 역할이 밝혀졌습니다.게놈 바이오.2018;19:18.
18. 코흐 A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
외.암의 DNA 메틸화 분석: 위치 재검토.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D 등.독립적 검증 세트를 사용한 표적 메틸화 기반 다발성 암 조기 발견 테스트의 임상 검증.앤 온콜.2021;32: 1167-77.
20. 하나한 D, 와인버그 RA.암의 특징.셀.2000;100: 57-70.
21. Hanahan D. 암의 특징: 새로운 차원.암 발견.2022년;12:31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. 정밀 종양학: 누가, 어떻게, 무엇을, 언제, 언제가 아닌가?Am Soc Clin Oncol 교육 도서.2017: 160-9.
23. Liu H, Meng X, Wang J. 실시간 정량적 메틸화
자궁경부암 검진에서 PAX1 유전자 검출.IntJ 산부인과 암.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP 등.대장암 검진을 위한 다중표적대변 DNA 검사.N EnglJ Med.2014년;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S 등.가이드 포지셔닝
시퀀싱은 세포 정체성과 종양 면역 감시 네트워크를 변경하는 비정상적인 DNA 메틸화 패턴을 식별합니다.게놈
결의안.2019;29:270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY 등.순환 무세포 DNA 메틸화 시퀀싱(THUNDER)을 통한 비침해적 다암 검출: 개발 및 독립적 검증 연구.앤 온콜.2023년;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, 외.히스톤 관련 유전자는 폐암에서 과메틸화되어 있으며
HIST1H4F는 범암 바이오마커 역할을 할 수 있습니다.암 입술.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V 등.전립선 특이 항원 스크리닝의 삶의 질 효과.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. 자기 부담 의료 서비스로 제공되는 암 선별 바이오마커 테스트의 임상 효과: 체계적인 검토.Eur J 공중 보건.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z 등.
보편적인 암 전용 마커로서의 과메틸화 PCDHGB7 및 조기 자궁경부암 검진에서의 적용.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X 등.자궁내막 브러시 샘플 및 자궁경부 긁힘에서 자궁내막암의 조기 발견을 위한 바이오마커로서의 과메틸화된 PCDHGB7.프론트 몰 바이오사이(Front Mol Biosci).2022년;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, 외.서로
전암 단계 및 전이 출현 추적을 위한 과메틸화를 포함한 SIX6의 독점적인 후성유전학적 변형.신호 전달 대상 Ther.2022년;7:208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS 돌연변이: 암에서 약물 투여가 불가능한 돌연변이에서 약물 투여가 가능한 돌연변이로.신호 전달 대상 Ther.2021;6:386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE 등.p16(INK4a)의 비정상적인 메틸화는 폐암의 초기 사건이며 조기 진단을 위한 잠재적인 바이오마커입니다.Proc Natl Acad Sci U SA.1998년;95: 11891-6.
35. 로버트슨 KD.DNA 메틸화와 인간 질병.Nat Rev Genet.2005년;6: 597-610.
36. WentzensenN, 워커 JL, 골드 MA, 스미스 KM, ZunaRE,
매튜스 C, 외.질확대경검사를 통한 다중 생검 및 자궁경부암 전구체 검출.J Clin Oncol.2015;33:83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD 등.FAM19A4의 메틸화 분석
자궁경부 긁힌 자국의 유전자는 자궁경부 검출에 매우 효율적입니다.
암종 및 진행성 CIN2/3 병변.암 이전 해상도(Phila).2014년;7: 1251-7.
38. 태국 AA, 솔로몬 BJ, Sequist LV, Gainor JF, Heist RS.폐암.랜싯.2021;398: 535-54.
39. 그루넷 M, 소렌센 JB.폐암의 종양 표지자로서 암배아항원(CEA).폐암.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, 외.폐암 검진, 버전 3.2018, 종양학 분야 NCCN 임상 진료 지침.J Natl Compr Canc Netw.2018;16:412-41.
41. 미국 암학회.암 사실 및 수치.미국 조지아주 애틀랜타: 미국 암학회;2023년 [2023년 3월 1일에 업데이트됨;2023년 8월 22일 인용].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, 외.평균 위험에 처한 개인을 위한 자궁경부암 검진: 미국 암학회의 2020년 지침 업데이트.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. 여성의 폐경기 출혈과 자궁내막암 위험의 연관성: 체계적인 검토 및 메타 분석.JAMA 인턴 Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
샤르마 A, 외.질경유 초음파 검사의 민감도
폐경기 여성의 자궁내막암에 대한 연구: UKCTOCS 코호트 내 사례 대조 연구.란셋온콜.2011;12:38-48.
45. 밥죽M, 버거M, 콤페라템, 곤테로P, 모스타피드AH,
PalouJ, 외.비근육침습성 방광암(TaT1 및 상피내암종)에 대한 유럽 비뇨기과 협회 지침 -
2019 업데이트.유로 우롤.2019;76: 639-57.
46. 아라곤-칭 JB.요로상피암과 방광암종의 진단, 생물학, 치료에 대한 도전과 발전.우롤 온콜.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
담관암종 - 진화하는 개념과 치료 전략.Nat Rev Clin Oncol.2018;15:95-111.
48. Ye Q, Ling S, Zheng S, Xu X. 간세포의 액체 생검
암종: 순환하는 종양 세포 및 순환하는 종양 DNA.몰 암.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, 외.범암
10,000명 이상의 중국 환자에서 순환 종양 DNA 검출.냇 커뮤.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R 등.고형 종양의 새로운 반응 평가 기준: 개정된 RECIST 가이드라인(버전 1.1).Eur J 암.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - 과거로부터 배워 미래를 건설합니다.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S 등.iRECIST: 임상시험에 사용하기 위한 응답 기준 지침
면역치료제 테스트.란셋온콜.2017;18: e143-52.
53. PantelK, Alix-Panabières C. 액체 생검 및 최소 잔존 질환 – 치료에 대한 최신 발전 및 영향.Nat Rev Clin Oncol.2019;16:409-24.
이 기사를 Qian C, Zou X, Li W, Li Y, Yu W로 인용하십시오. 암에 대한 전초 기지: 보편적인 암 전용 마커.암 Biol Med.2023년;20: 806-815.
도이: 10.20892/j.issn.2095-3941.2023.0313
게시 시간: 2024년 5월 7일